醫療器械ce認證標志:
醫療器械通過CE標志認證,獲得歐洲市場準入CE標志認證醫療器械BSICE標志是醫療設備制造商聲稱產品符合所有相關歐洲醫療設備指令的基本要求的聲明。該指令概述了歐盟(EU)醫療器械的安全性和性能要求,CE標志是將設備投放歐盟市場的法律要求。
醫療器械通過CE標志認證,獲得歐洲市場準入CE標志認證醫療器械BSICE標志是醫療設備制造商聲稱產品符合所有相關歐洲醫療設備指令的基本要求的聲明。該指令概述了歐盟(EU)醫療器械的安全性和性能要求,CE標志是將設備投放歐盟市場的法律要求。

醫療器械ce認證流程:
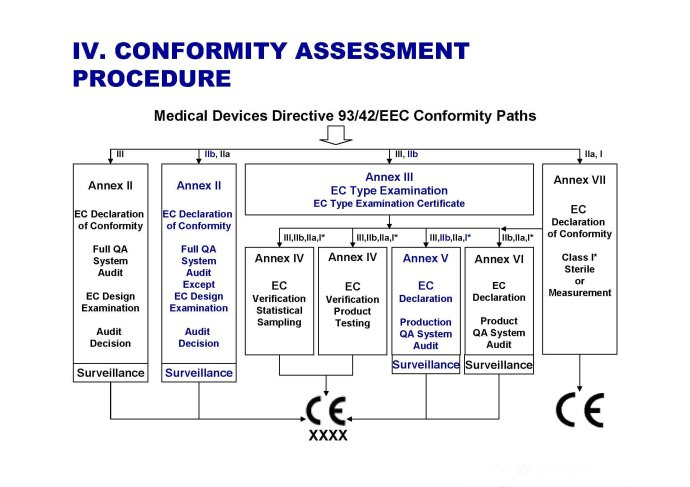
醫療設備的要求正在發生變化。自20世紀90年代以來,歐盟醫療器械的核心法律框架包括三個指令:
1. 關于有源植入式醫療器械(AIMD)的指令90/385 / EEC
2.關于醫療器械(MDD)的第93/42 / EEC號指令
3.關于體外診斷醫療器械(IVDD)的指令98/79 / EC
4.這些指令正在被2017年5月5 日發布的新醫療器械法規和IVD法規所取代,在指定認證機構對新法規進行認證之前,所有醫療器械必須滿足上述指令中規定的基本要求。
在可能的情況下,可以使用相關標準來證明符合指令統一標準清單中定義的基本要求 。
醫療器械分三個等級:
I級 - 低風險
IIa類 - 中等 - 低風險
IIb類 - 中等 - 高風險
III級 - 高風險
您的合規途徑根據醫療器械指令93/42 / EEC CE標志,商通檢測是使用質量體系合規路線的附屬機構 ,您需要填寫一份簡單的表格,告知我們您的公司和產品。我們將使用此信息來驗證與您的產品相關的要求,并與您合作以確定合格評估的最佳選項,包括我們可以幫助您的任何其他服務。
在歐盟擁有良好的業務,在英國,德國,法國和荷蘭設有辦事處。我們已幫助數百家符合歐洲CE標準的醫療設備制造商。我們的包括:
1.協助產品分類
2.驗證適用的標準和測試要求
3.技術文件或設計檔案編輯,或審查您的文件
4.查看現有的營銷材料,標簽和用戶手冊信息,以確保合規性和一致性
5.驗證符合基本要求
6.根據提供的臨床數據準備臨床評估報告
7.實施,修改和維護符合歐洲和其他國際要求的質量體系(通常是ISO 13485)
8.歐洲的授權代表服務
9.風險評估和管理(ISO 14971)
10.制定警惕和上市后監督程序
